티스토리 뷰

<시작하며>
인간의 본성. 탐욕적이다. 조급하다. 게으르다. 나는 오늘 본성대로 살았는가?
나의 오류는 무엇이고 어떻게 수정할 것인가?
나의 포지션은 지금 어디이고, 앞으로 어디로 향하고 싶은가?
최저의 수수료와 최고의 서비스로 고객님을 응원합니다. - 이베스트투자증권
ebestsec.co.kr
<제약바이오 산업분석>
[강하나 제약/바이오]2022년 제약바이오는 강하나?(2021.11.8. 이베스트투자증권 산업분석)


임상 2단계라.

2상에서 성공률 뚝 떨어지는데, 비용도 비싸. 최소 200억원 이상이라고 하네.

2상 실패는 주로 '유효성' 문제라고 한다.

1) 계약금을 주고
2) 전임상~ 허가완료, 단계별 성공 보수 지급
3) 신약출시에 따른 로열티(매출액 대비 비율로) 지급.

제일 짧게 잡아도 2+2+3+0.5 = 7.5년 걸림 시판까지.
비임상, 전임상 완료 했어도 최소 3.5년 걸림 시판까지.
중요한 건 실제 환자를 대상으로 30%의 성공률을 보이는 임상 2상을 통과하는 것.


매출액 대비 연구개발비. 좋은 참고자료.

돈 대주는 국내외 대형제약바이오회사들과 파트너링 체결하며 라이선스아웃 할 수밖에 없는 상황.

점점 줄여나가는 식.

생각보다 낮은 성공률. 그리고 큰 비용. 후딱 처리해야 함.

과거 1세대 제약사가 제네릭 내수시장에 머물렀다면 현재 2세대 제약사는 신약개발과 글로벌 진 출을 타겟으로하는 방향으로 변하고 있음.

일단 라이선스아웃으로 돈 확보하고, 나중에 그 돈으로 자체 신약개발 하자~

비싸고 잘 팔리는 바이오의약품.

의약품의 종류.

바이오 의약품의 정의와 특징. 약효가 우수하고 부작용이 적어 신약승인까지 성공율이 높음.

항체의약품이라..

바이오의약품 → 항체의약품
항암제를 중심으로 커지는 바이오의약품 시장. 그 중심에 '키트루다 와 옵디보'등의 항암제가 있다.

@제약바이오 산업의 특징. 기존 약물 대비 이점이 없다면 임상 승인의 이유가 없음.

무형자산 인식 조건.

신약개발 연구개발비 회계처리.

라이선스 아웃의 경우 3상 이전 계약이 진행되어도 가능성이 높다고 판단된 경우 자산화 가능.

라이선스 아웃. 회계처리 방법. 최초 선급금 수익인식, 추후 마일스톤과 로열티는 후속 계약사항에 따라 인식.
<바이오일레븐>
자~ 갑자기 왜 바이오공부야?? 할 수 있다. 바로 바이오일레븐을 위한 공부!!

4탄에서 2020년 바이오일레븐이 삼성바이오로직스와 면역항암제 위탁개발 생산CDO 계약을 체결한 것을 확인했다.
민앤지 `바이오일레븐`, 삼성바이오로직스와 면역항암제 `BN-101A` 개발 협력
IT서비스 기업 민앤지는 종속사 바이오일레븐이 삼성바이오로직스와 3세대 면역항암제 `BN-101A`의 위탁개발생산(CDO) 계약을 체결했다고 19일 밝혔다. 민앤지는 올해 관계사 바이오일레븐을 주요
www.mk.co.kr
민앤지 '바이오일레븐', 삼성바이오로직스와 면역항암제 'BN-101A' 개발 협력(20.10.19. 매일경제 기사)
바이오일레븐은 삼성바이오로직스와 3세대 면역항암제 'BN-101A'의 위탁개발생산(CDO)계약 체결.
'BN-101A'는 암세포의 면역공격 회피인자인 PD-L1의 기능을 차단하고 항암T세포의 활성을 촉진시킨다.
세포 실험과 동물 실험을 통해(전[비]임상) 기존 항암제와 비교해 항암 효과가 우수하고(2상 통과를 위한 유효성) 특히 다른 항암제와의 병용 시 그 효능이 우수함을 확인했다.
기사에는 2022년 글로벌 임상 1상을 진행 예정이라고 되어 있는데, 현재는 22년 하반기 비임상 종료 목표이므로 23년 글로벌 임상 1상을 할 것으로 보인다.
추가적으로 면역항암제의 항암 효능을 높이는 마이크로바이옴 병용 치료제 자체 개발에 집중하는 중이라고 한다.

삼성바이오로직스에서 IND까지 해준다는 것.
1. 23년 글로벌 임상 1상 진입을 한다고 치면, 1~3상까지 3~10년이 걸릴 수 있다는 것. 그렇다면 선택지는
1) 비임상 성공 이슈화 되면 판다.
2) 통상 63.2% 성공률인 임상1상 성공하면 판다.
3) 통상 30.5% 성공율인 임상2상 성공하면 판다.
지난 10년간 임상1상 → 승인까지 성공률은 7.9%라고 하고 임상 2상 → 3상 성공율은 28.9% 라고 하니 낮은 성공확률에 후기임상으로 갈수록 큰 금액이 필요하기 때문에 반드시 비중 조절하여 리스크 낮출 것!!
<면역항암제 시장동향>
한국바이오협회
한국바이오협회는 바이오산업분야 대표단체로서 산업계 발전 및 산업화 촉진을 위한 구심체로서의 역할을 하고 있습니다.
www.koreabio.org
면역항암제 기술 및 시장동향(21.7.18.한국바이오협회 면역항암제 관련 PDF 파일)

CAGR 9~12%

면역항암제 분야는 전체 중 20% 차지, 선도하는 부문 예상.


면역항암제의 특징. 부작용 상대적 낮음.
1) 면역관문억제제
2) 면역세포치료제
3) 치료용 항체
4) 항암백신

면역관문억제제. T세포가 암세포 공격하는 것을 방해하는 녀석들을 차단시킴. PD-L1(Programmed Deah-Ligand-1)을 인식하는 항체.

암세포가 면역세포(T세포)의 PD-1에 수용체에 PDL-1 을 합체시켜 면역작용을 방해하기 전에 암세포와 반응할 수 있는 항체를 넣어서 방해를 차단해 버리는 것.
바이오일레븐이 개발 중인 'BN-101A'도 PDL-1에 작용하니, 면역관문억제제 이겠군!!
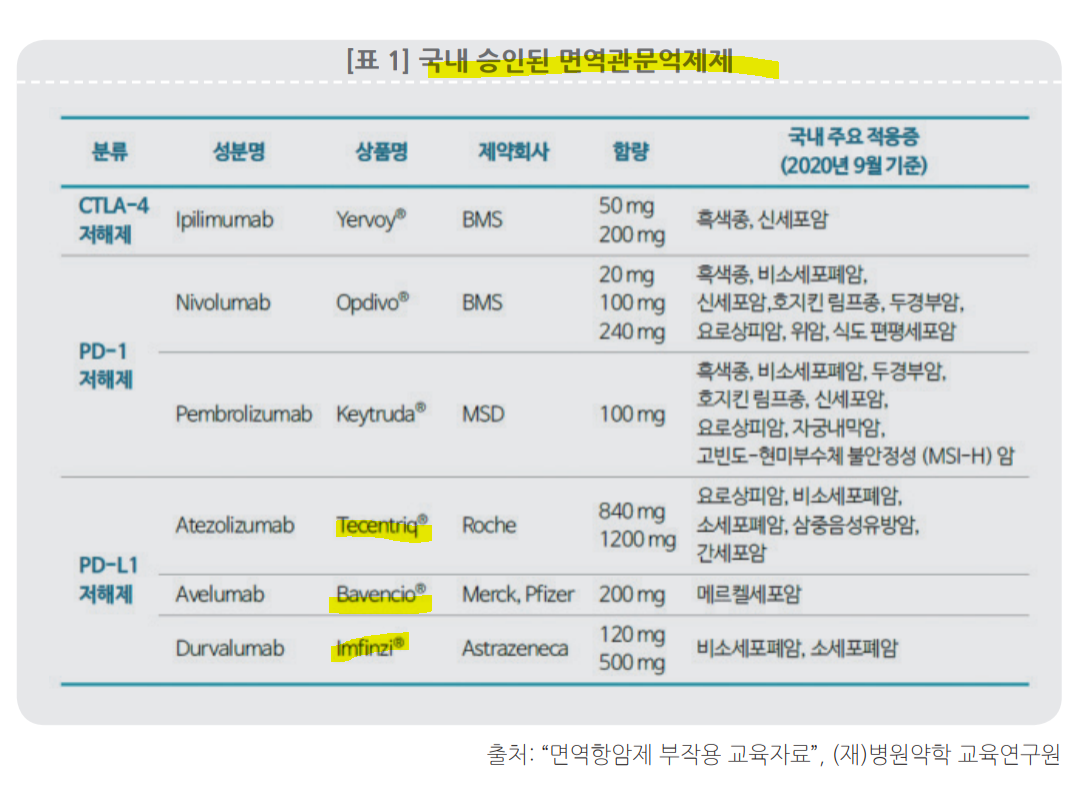
티센트릭, 바벤시오, 임핀지.

면역관문억제제는 면역조절제에 속한다.

면역관문억제제 글로벌 시장규모.

19년 후기 임상 중 47%가 면역관문제제 → 인기가 많음.


글로벌 의약품 중 면역관문억제제의 비중이 매우 크다.

그렇다면 바이오일레븐의 'BN-101A'의 치료율은 글로벌 면역관문억제제 1,2 위를 차지하고 있는 머크사의 키드루다와 BMS사의 옵디보보다 높을 수 있을까?? 위에 기사에서는 김석진 소장은 기존 항암제 대비 항암효과가 우수하다고 말하긴 했다.
임상 2상의 주요 실패 원인은 '유효성'에 있고, 기존 약물대비 이점이 없다면 임상승인의 이유가 없다는 말이니까..
<면역관문억제제 주요 기업 체크>

로슈사의 티센트릭. 처음에는 요로상피세포암종을 위한 치료제로 FDA 승인받고 확장시켜 나갔구나.

BMS사의 옵디보. 진해성 흑색종 치료제로 FDA승인.

머크사의 키드루다. 진행성 흑색종을 위한 치료제로 FDA 승인.

면역관문억제제는 가장 성공적인 형태의 면역항암제로 분류 강한 성장성을 보임. 치료율 30%의 한계성 있음.

작은 기업에게도 기회의 문이 열려 있다고 볼 수 있음. 바이오일레븐의 'BN-101A'에게도 기회의 문이 열려 있는 것일까??
자 그렇다면, 바이오일레븐의 'BN-101A'의 경쟁력은 어디서 확인할 수 있을까?
가정 1) 후보물질 기술 이전을 해 준 SKAI(스크립스코리아)의 경쟁력을 찾아본다.
가정 2) 프로젝트를 총괄하는 바이오일레븐의 공동대표이자 부설 연구기관인 김석진좋은균연구소의 연구소장 김석진의 논문을 찾아본다.
<가정1 스크립스코리아>
스크립스코리아항체연구원
유일의 항체 연구 공익 연구소, 강원도 춘천 소재
skai.or.kr
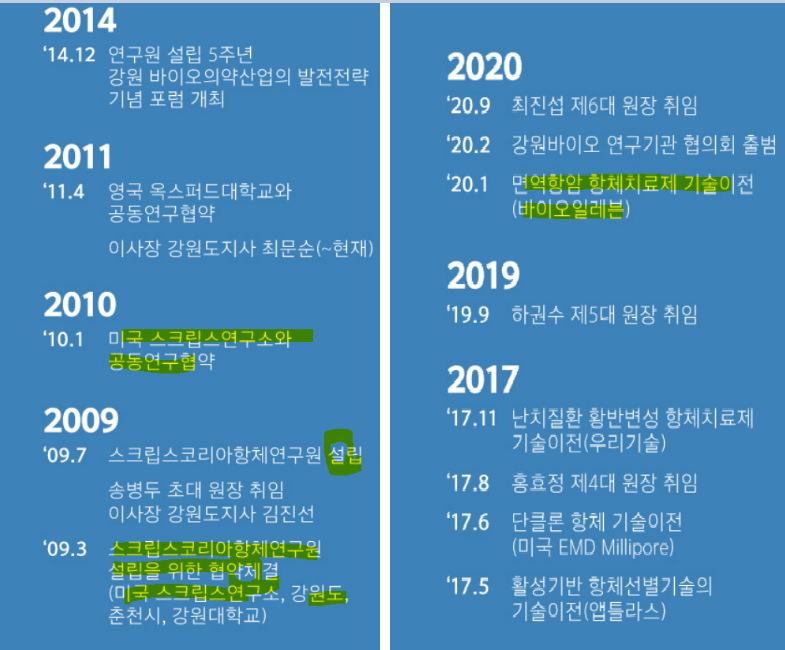
SKAI는 미국 샌디에이고에 있는 세계적인 생명의학연구소인 스크립스연구소의 해외 최초 분원으로 강원도에 위치하고 있다.
09년도에 설립되었고, 강원도와 춘천시로부터 지원을 받아 운영 중이다.
20.1. 바이오일레븐에 BN-101A 후보물질을 기술이전해 주었다.

바이오일레븐 기술이전 비용 200억원인 것을 확인할 수 있다.

미국 스크립스연구소는 세계에서 가장 큰 민간생의학 연구소.
공동연구 수행, TSRI(The Scripps Research Institute) 보유 기술 및 물질 무상 사용.
그래. 믿을만한 연구기관에서 후보물질을 기술이전 받았어. 그리고 이 물질 가지고 삼성바이오로직스 CDO(위탁개발) 계약 체결을 하여 비임상 진행 중이고 글로벌 임상 허가 신청 지원까지 해 주는 걸로 알고 있지. 그렇다면 이 후보물질이 2상을 통과할 수 있는 '유효성'을 갖고 있다는 것을 미리 알 수 있는 방법은 없을까??
<가정2 김석진 연구소장(대표)>
김석진 대표 "마이크로바이옴 전문 '테크바이오 1호' 꿈꾼다"
“저희는 면역회사를 지향합니다. 면역을 결정하는 중요 요인이 ‘제2의 유전자’라 불리는 ‘마이크로바이옴’(장내 미생물)이라고 보고 10여년간 연구해왔어요.”김석진 바이오일레븐 연구
pharm.edaily.co.kr
김석진 대표 "마이크로바이옴 전문 '테크바이오 1호' 꿈꾼다"(21.11.2. 팜이데일리 기사)
김소장은 암이 외부 균의 침입으로 생기는 것이 아니라 내 몸 세포가 바보같은 행동을 하여 생기는 것이라 면역작용으로 세포를 죽이기 힘들다고 함.
그렇기 때문에 표적치료보다 면역세포를 도와주는 면역항암제에 주목하게 되었다고 말함.
눈여겨볼 부분은
면역항암제 효과가 컸던 대변을 분석→ 대변 구성이 약에 반응하지 않던 환자와 달랐음 → 쥐 실험 → 대변이 약효를 결정하는 주요 요소라는 점 발견 → 면역항암제 개발에 나섬
그렇다면, 김소장은 면역항암제 효과가 컸던 환자의 대변에서 신약개발의 아이디어를 얻었고 → SKAI 후보물질 의뢰 → 기술이전 받음 → 삼성바이오로직스 CDO로 이어진 것인가??
김소장에 대하여 좀 더 알아보자.

바이오일레븐 홈페이지에 나와있는 R&D → 대외발표,특허 이다.

구글 학술검색을 통해 찾아냈다.

김석진 소장님 팔로잉도 했다ㅋㅋㅋㅋㅋ
Delayed Establishment of Gut Microbiota in Infants Delivered by Cesarean Section
The maternal vaginal microbiome is an important source for infant gut microbiome development. However, infants delivered by Cesarean section (CS) do not contact the maternal vaginal microbiome and this delivery method may perturb the early establishment an
www.frontiersin.org
Delayed Establishment of Gut Microbiota in Infants Delivered by Cesarean Section(2020.10.11.Front.Microbiol. Original Research Article)
자 이제 구글 번역 돌려보자 ㅋㅋㅋ

김석진 소장의 이름과, 바이오일레븐, 대학교들이 보인다.

VD(Vaginally Delivery.자연분만)
CS(Cesarean section. 제왕절개)
Microbiome(미생물군집)

자연분만된(VD) 영아에서 산모의 장내 미생물군의 전파 영향을 확인.
반면, 제왕절개(CS) 분만된 영아는 장내 미생물총의 교란 및 성숙 지연과 관련 있고 아동비만, 면역 질환, 감염 등을 불러올 수 있음.

CS 영아와 다르게 VD 영아 대변에서 시간 경과에 따른 장내 미생물 다양성이 발견되었음.
CS 영아에게 산모의 질내 미생물군집을 전달한 결과 부분적 회복이 입증되었음. 이에 따라 아동비만, 면역질환, 천식 등의 위험을 최소화할 수 있음.

연구에 동참한 저자들과 지원 내역.
대변과 마이크로바이옴, 면역에 관한 연구를 한 내역은 어느정도 알겠다.
그렇지만 항암치료와 직접 연결된 논문은 발견하지 못했다.
다시 기술이전을 해 준 스크립스코리아로 돌아가보자.

스크립스코리아→ 연구분야 → 연구성과
PD-L1 관련 논문이 확인된다.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7921862/
A Novel Anti-PD-1 Antibody Exhibits Antitumor Effects on Multiple Myeloma in Murine Models via Antibody-Dependent Cellular Cytotoxicity(2021.3.1.Biomol Ther (Seoul))

국제학술지는 아니다.
영어로 써서 한국에 내놓은 것.

혈액 악성 종양인 다발성 골수종의 치료에서 T세포의 활성화를 방해하는 체크포인트를 차단시키는 면역관문억제제 치료가 가능성을 보여주었고,
다발성 골수종 환자에게는 PD-1 보다 PD-L1 차단 요법이 필요하다는 것.

PD-L1 차단으로 암세포의 성장을 직접적 억제.
새로운 항-PD-L1 항체를 개발.

새로 만든 항체는 시장에 나와 있는 치료 항체와 다르다는건가??

만든 항체는 다발성 골수종 치료에 적용될 수 있고, 상당한 항종양 효과를 보였다고 함.
정리를 해보면,
1) 글로벌 면역관문억제제 MS 1,2 위인 머크사의 키드루다와 BMS사의 옵디보는 진행성 흑색종 치료제로 FDA 승인을 받았고, 로슈사의 티센트릭은 요로상피세포암종 치료제로 FDA 승인을 받았다.
2) 지난(20.10.19.)기사에서 바이오일레븐의 신약은 기존 항암제 대비 항암 효과가 우수하다고 말했었다.
3) SKAI는 세계 최대 민간생의학 연구소인 미국 스크립스연구소로부터 보유 기술 및 물질 무상 사용을 지원받는다.
4) SKAI는 바이오일레븐에게 'PD-L1 면역항암 항체치료제 기술이전 (200억원)'한 것을 주요성과로 홈페이지에 등록해 두었다.
5) 스크립스코리아 연구성과 논문에서 다발성 골수종(혈액암) 환자에게 상당한 항종양 효과를 보이는 새로운 항-PD-L1 항체를 개발했다는 내용을 찾아볼 수 있었다.
6) 위 내용을 토대로 바이오일레븐의 'BN-101A'는 다발성 골수종 치료제로 FDA 승인을 노려볼 것으로 보이며, 2022년 말 전임상 종료를 목표로, 2023년 글로벌 임상 1상 에 돌입할 것으로 보인다.
'관심 기업 > 헥토그룹' 카테고리의 다른 글
| 민앤지 분석 자문자답. 1Q22 분기보고서 간단 리뷰. (0) | 2022.05.18 |
|---|---|
| 민앤지 분석 자문자답. 2021 사업보고서 간단 리뷰. (0) | 2022.03.25 |
| 민앤지 분석 자문자답8탄. 3Q21 실적 리뷰. 호실적. 4분기에도 좋다. 변화 과정은? (0) | 2021.11.18 |
| 헥토그룹 분석 자문자답. 7탄. 민앤지 벨류에이션 멀티플, 적정주가 산정 방식은?? (0) | 2021.11.07 |
| 헥토그룹 분석 자문자답. 6탄. 민앤지, 세틀뱅크, 바이오일레븐 마케팅 분석. SWOT, 3C, STP [분기별 업데이트] (0) | 2021.11.07 |
- Total
- Today
- Yesterday





